中欧体育app全站.噬菌体展示抗体筛选之筛选策略
发布时间:2024-03-05 18:43:04 来源:zoty中欧体育官网 作者:zoty中欧体育 中欧体育app全站当使用治疗性抗体时,抗体一直保持循环,直到被细胞内吞。在内吞作用后,抗体被定向到溶酶体,在那里它们可以与新生FC受体(FcRn)结合而被再利用。
上一次小编为大家介绍了在噬菌体展示技术抗体发现过程中抗原的呈递策略,本期就为大家介绍在发现抗体过程中的一些常用且行之有效的筛选策略。在噬菌体展示抗体筛选过程中,结合buffer的选择,选择压以及筛选策略的考虑是最为关键的步骤。为了富集与靶标分子结合的克隆,必须保证有合适的“选择压”,使得被保留的次代噬菌体pool中不含适应性较低的变异体,然后扩增以备下一轮筛选使用。
缓冲液的选择应该除了考虑到靶标的稳定性,还要考虑实际应用场景中结合微环境以及最小限度的非特异性结合。不相关的蛋白质,非离子型剂去垢剂以及生理盐浓度的使用有利于降低本底。同时还有一些其他条件,如有些靶标可能要求在缓冲液中加入二价阳离子或其他辅助因子,蛋白质辅助因子可以与靶标共固定,也可加入分选缓冲液,甚至可作为捕获靶标的一种方法。
常见的选择压的考虑主要有:靶分子的浓度,结合时间,洗涤强度等,其他提高选择压的技术包括:使用变性剂(如酸、尿素和胍)、有机溶剂、提高温度或在洗涤缓冲液中提高竞争配体或靶标的浓度。其中第一轮筛选尤为重要,第一轮筛选的目的是为了从构建的文库中尽量多地捕获阳性克隆,同时除去非特异的克隆,应该用多孔的包被后的靶标或大量的可溶性靶标,来确保大量捕获结合后的噬菌体,以保持文库的多样性。一般要求洗脱噬菌体滴度在104~106cfu,低于104cfu,说明选择压太高,高于106cfu说明选择压不够。在随后的几轮筛选中,选择压应该随着富集度的提高而提高,通过多次洗涤并增加洗涤时间,可以筛选出具有高亲和力克隆。
噬菌体展示最大的优势就是可以根据我们想要的结果来进行偏向性的筛选,因此筛选策略非常重要。对于筛选方法,常见的有负筛选,竞争筛选,交叉筛选等。但若想要获得针对挑战性靶点的分子和具有某些结合特性的分子,我们需要针对性地选择筛选的策略。
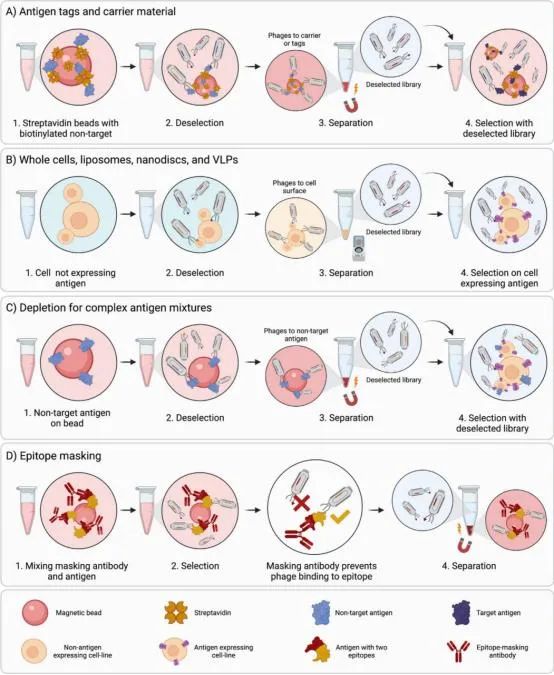
在筛选过程中,可能会筛选到针对抗原上的所有物质的结合物,比如标签、融合蛋白和支持基质。为了克服这个问题,通常可使用对非目标进行负向筛选来限制针对目标抗原以外的抗体的富集。例如,在使用链霉亲和素磁珠对生物素化蛋白进行筛选之前,可以将文库预先与链霉亲和素磁珠和生物素化非目标蛋白结合,以减少这种不需要的结合物的比例(图1a)。
在进行转染细胞系进行筛选时,可以使用模拟转染的细胞或未转染的细胞进行负向筛选。当使用内源性表达靶蛋白的细胞时,表达靶蛋白的相同类型细胞可用于负向筛选(图1b)。对于脂质体、纳米盘和VLPs,也可以使用类似的策略,即在对抗原展示颗粒进行筛选之前,使用用于表达而不嵌入抗原的颗粒进行负向筛选。在使用哺乳动物或细菌细胞的表面分子进行筛选时,可以用类似于靶细胞的非靶细胞进行负向筛选。例如当目标是识别针对B细胞的抗体时,可用T细胞进行负向筛选。
对于未知的或复杂的靶分子,如全细胞或不纯的蛋白,可进行严格的负向筛选。例如在事先不知道目标蛋白的情况下对整个细胞进行负向筛选。这些情况下,靶抗原是未知的,但非靶抗原是已知的,这种情况下可以进行严格的负向筛选。在负筛过程中,噬菌体展示库先与非目标抗原对应的重组蛋白一起孵育。然后将未结合的噬菌体转移到目标抗原上进行筛选(图1c)。
治疗性抗体结合目标抗原的表位通常是至关重要的,因为这可以决定该抗体是否具有治疗价值。为了找到能阻断受体和配体结合的抗体,洗脱时可以通过加入高浓度的配体来洗脱可与配体竞争结合的抗体。但是,这会导致部分低亲和抗体也被洗脱。抗体阻断,也被称为表位掩蔽,是另一种筛选针对抗原的特定位点抗体的策略。在筛选过程中,先前发现的结合抗原不良表位的抗体被阻断。这些抗体结合并阻断抗原的某些表位,使在筛选过程中无法获得该表位的噬菌体抗体。那么结合新表位的抗体就可以被富集(图1d)。
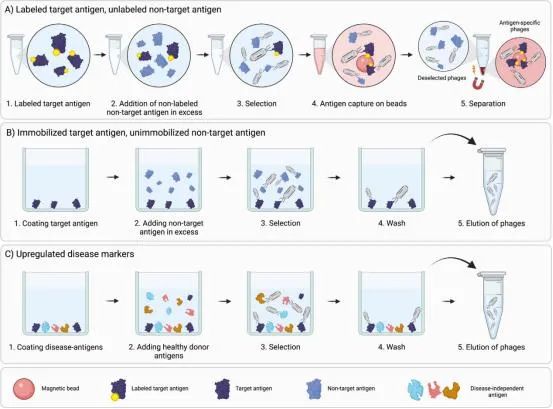
对相关抗原的预先负向筛选并不是100%有效的,并且与靶点特异性和相似表位结合的亲和力有关。并不是所有的抗体都能在特定的时间段与相应的抗原结合。一些非特异性的抗体在负筛结束的时间点不会完全与非目标抗原结合,可能会导致这些抗体与目标抗原结合。为了避免这种情况,可以在竞争抗原存在的情况下进行筛选。
在竞争筛选时,靶抗原和非靶抗原与抗体库混合,靶抗原和非靶抗原与抗体竞争结合。使用过量的非靶抗原与表位的结合,让文库与靶抗原和非靶抗原同时孵育,增加了结合靶抗原特异性表位的抗体的比例。在筛选完成之后,与目标抗原结合的抗体会被富集。筛选与靶抗原结合的抗体也可以用生物素标记靶抗原,不标记非靶抗原(图2a)。也可通过不同的方式呈递靶抗原和非靶抗原,如将靶抗原固定在塑料表面上,在溶液中添加非靶抗原(图2b)。与健康样本相比,在病变组织、细胞中高表达的抗原通常是治疗或诊断的相关靶点。在筛选这些靶点时,可使用健康样本来进行负向筛选,减少针对健康样本中存在的各种抗原的结合物。并且在筛选过程中会存在竞争的情况,这也可以帮助我们发现针对这些高表达靶点的抗体,而不仅仅是针对单一靶点的抗体。通过改变在竞争时添加的非靶标抗原的数量,可以倾向性地筛选针对某种表达水平的靶标抗体。抗体将竞争地与靶抗原和非靶抗原结合,通过表达水平的高低来决定抗体的去留(图2c)。
在许多情况下,治疗性抗体需要与靶标抗原的同源基因或不同突变体结合。筛选的治疗性抗体能同时识别小鼠和猴,那么将其结合人类靶点的临床前研究将更容易进行。
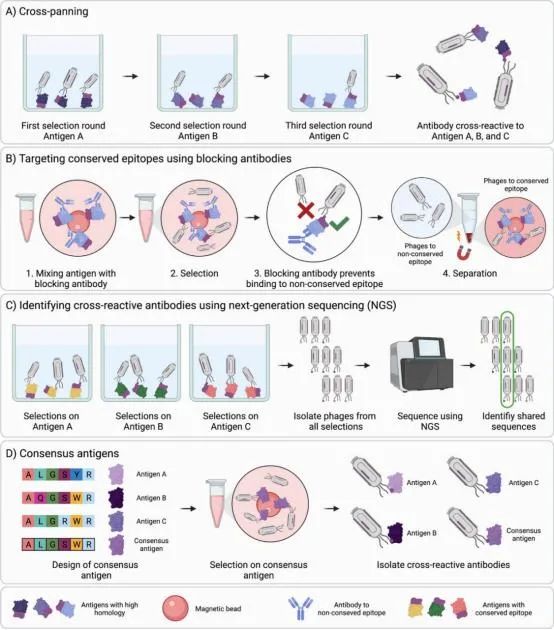
得到有交叉反应抗体的一种方法是进行交叉筛选,即在不同的轮次之间交替使用抗原进行筛选(图3a)。使用该技术已发现针对艾滋病毒和多个物种蛇毒中的细胞毒素的抗体。该方法成功与否取决于相关抗原之间的保守程度。要求对同源物或低保守的同源物的广泛交叉反应可能会导致得到低亲和力抗体、非特异性抗体甚至无法得到抗体。
在筛选不同轮次中使用相同抗原时,为了得到有交叉反应的抗体,可以使用抗体阻断的方法来引导筛选针对抗原保守表位的抗体(图3b)。或者是通过下一代测序(NGS)来评估用不同蛋白交叉筛选的回收物中富集到的抗体(图3c)。使用该方法已找到抗血清白蛋白的结合物。
3.一致抗原筛选为了得到交叉反应性抗体也可以选择在筛选中使用一致抗原(图3d)。一致抗原是通过对多个同源抗原的序列比对来构建一个“平均”抗原。可根据相似的化学性质选择氨基酸或预测免疫原性最大的氨基酸。使用共识毒素对马进行免疫得到针对各种蛇的短神经毒素的多克隆抗体,并且推测使用共识抗原也可能在基于噬菌体展示的抗体发现技术中有积极作用。
当使用治疗性抗体时,抗体一直保持循环,直到被细胞内吞。在内吞作用后,抗体被定向到溶酶体,在那里它们可以与新生FC受体(FcRn)结合而被再利用。这可显著地增加抗体的半衰期。抗体与抗原结合后,抗原-抗体复合物要么在溶酶体中降解,要么被循环利用。为了避免抗原的循环和不必要的抗体降解,可以设计使抗体能与酸性核内体上的抗原分离,这样抗原在抗体被循环时就能被降解(图4a)。研究表明,使用对pH依赖的抗体可以降低血浆中的抗原浓度,该抗体与FcRn亲和力比传统的抗体更强。并且可以增强抗体-药物偶联物的细胞毒性,并促进抗体通过血脑屏障的胞吞作用。为了发现对pH依赖的抗体可以选择在中性的pH下进行筛选结合,在pH5.4的环境下进行洗脱(图4b)。另一种增加抗体半衰期的策略是拥有具有依赖于离子存在结合特性的抗体。钙依赖可以用来从核内体中回收抗体。例如,在含钙缓冲液中用IL-6R进行筛选,随后加入EDTA来螯合Ca2+,洗脱钙依赖性抗体,从而发现了一种能快速从血浆中清除抗原的抗体。根据抗体的最终使用情况,可以在筛选过程中实现对有额外要求抗体的富集,如高稳定性抗体或慢解离抗体。富集稳定性抗体的一种方法是在筛选的步骤中增加温度或添加蛋白酶。为了发现慢解离的抗体,可在筛选的轮次中逐步降低抗原浓度,并增加清洗的次数。
 产品说明书
产品说明书


